上海宇玫博生物科技有限公司品牌商
9 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
上海宇玫博生物科技有限公司
入驻年限:9 年
- 联系人:
宇玫博
- 所在地区:
上海 浦东新区
- 业务范围:
技术服务、耗材、实验室仪器 / 设备、细胞库 / 细胞培养、论文服务、试剂、原辅料包材
- 经营模式:
生产厂商 经销商 科研机构
公司新闻/正文
IF=14.1 | Umibio透射电镜(TEM)和粒径(NTA)助力客户卵巢癌进展研究!
36 人阅读发布时间:2026-01-30 16:36

近期,来自复旦大学生物医学研究院的周祥教授,中南大学湘雅医院的张瑜教授和上海宇玫博生物科技有限公司的高博博士团队在Advanced Science杂志发表了题为“Dual Targeting of Mutant p53 and SNRPD2 via Engineered Exosomes Modulates Alternative Splicing to Suppress Ovarian Cancer”的科研论文,IF=14.1。

研究背景:
卵巢癌,尤其是高级别浆液性卵巢癌(high-grade serous ovarian carcinoma,HGSOC)是致死性最高的妇科恶性肿瘤之一,具有高复发率和固有化疗耐药性,临床治疗面临巨大挑战。TP53是卵巢癌中突变频率最高的基因,突变型p53(mtp53)不仅使p53蛋白失去抑癌功能,更使其获得致癌功能,主动驱动肿瘤进展和耐药,但其具体作用机制尚未完全阐明。与此同时,选择性剪接作为一种关键的转录后调控机制,其失调在癌症发生、转移和耐药中扮演重要角色,但mtp53如何调控选择性剪接以促进卵巢癌进展仍不清楚。SNRPD2是核心Sm蛋白复合体的一个组成部分,SNRPD2失调与异常mRNA异构体生成有关,会导致包括癌症在内的多种疾病。本文旨在揭示mtp53调控卵巢癌进展的新机制,并为克服临床耐药提供新的治疗靶点和策略。
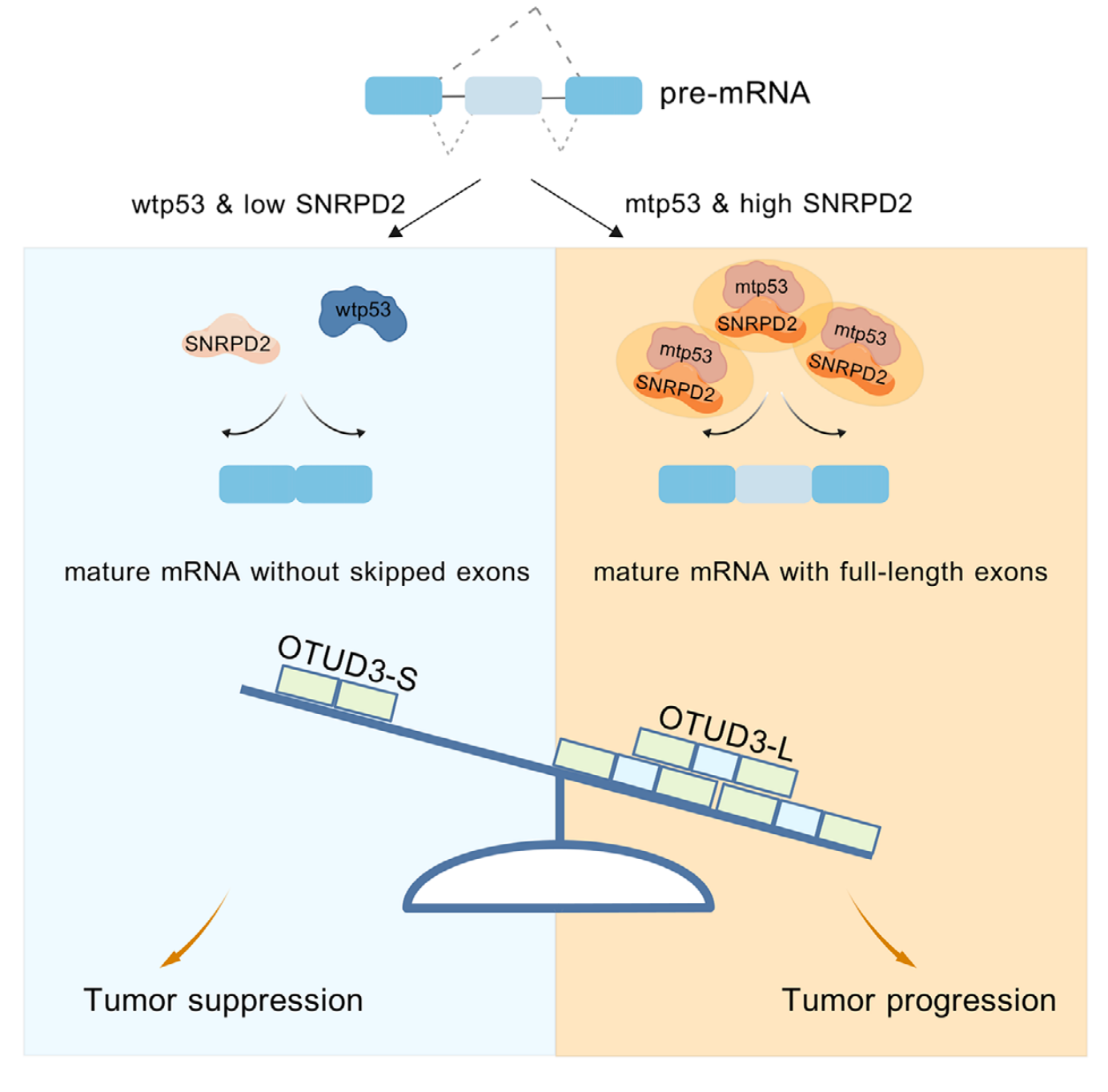
研究成果及意义:
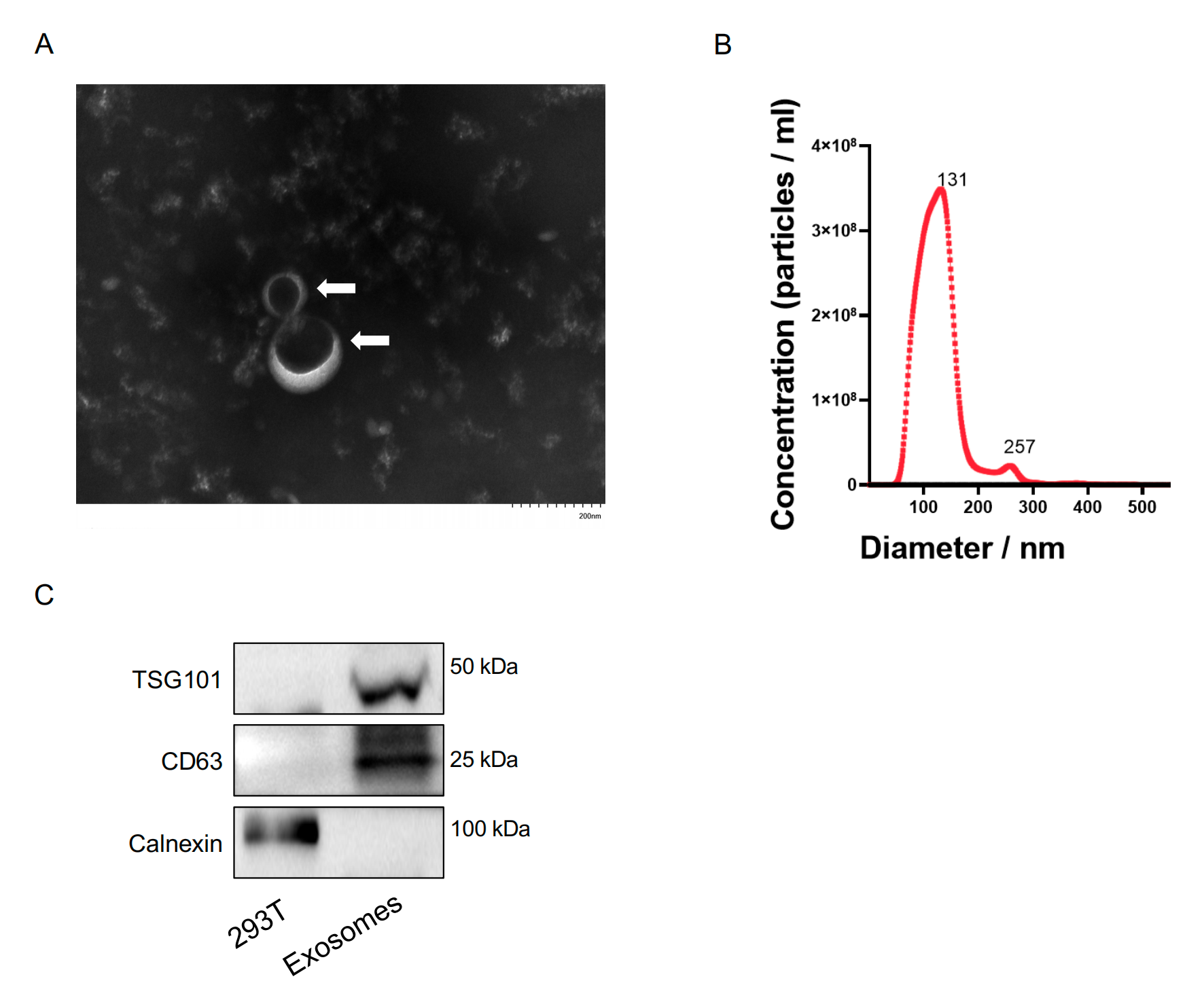
在本研究中,作者首先在携带mtp53-S241F突变的卵巢癌组织中,通过蛋白质组学筛选出mtp53相互作用蛋白SNRPD2。随后进行了免疫共沉淀-免疫印迹(co-IP-IB)验证,结果发现在多种卵巢癌细胞系(TOV112D, ES-2, OVCA420, OVCAR-3)中SNRPD2与多种mtp53突变体(R175H, S241F, R273H, R248Q)特异性结合,但不与野生型p53结合。为了确定SNRPD2在卵巢癌中的作用,作者进行了细胞功能实验和动物实验,结果发现SNRPD2过表达促进卵巢癌细胞增殖、克隆形成、迁移,并抑制凋亡;SNRPD2敲低抑制卵巢癌细胞增殖、克隆形成、迁移,并诱导凋亡。在卵巢肿瘤异种移植动物模型中,SNRPD2过表达加速肿瘤生长,而敲低则显著抑制肿瘤生长。这些结果表明SNRPD2作为致癌蛋白发挥作用,从而促进卵巢癌的生长和进展。前体mRNA的选择性剪接是真核细胞中精确调节的转录后过程,它响应环境刺激而发生,有助于RNA、蛋白质和细胞多样性。作为一种Sm蛋白,SNRPD2被认为是一种替代剪接调节因子。为了探讨mtp53与SNRPD2是否共同调节前mRNAs的剪接,作者对敲除mtp53 或SNRPD2 的OVCA420卵巢癌细胞进行了RNA测序分析和剪接分析,结果发现敲低mtp53或SNRPD2导致大量重叠的差异剪接基因,其中外显子跳跃是最主要的事件;mtp53促进SNRPD2与SMN蛋白的相互作用,增强剪接体功能。在机制方面,OTUD3是一种含OTU结构域的去泛素酶,调控多种信号通路。OTUD3第4外显子跳跃产生短型OTUD3-S,表现为抑癌功能;而长型OTUD3-L 促进肿瘤生长。为了验证关键剪接靶点OTUD3的功能,作者构建了稳定过表达OTUD3-L或OTUD3-S的细胞系并进行了细胞功能实验,结果发现OTUD3-L 促进细胞增殖、克隆形成、迁移,抑制凋亡,OTUD3-S 则完全相反,发挥抑癌作用;同时敲低OTUD3-L能抑制癌细胞恶性表型。为了研究外泌体递送系统共同靶向mtp53和SNRPD2 是否可能成为卵巢癌的潜在治疗方法,作者设计了特异性siRNA并构建了工程化外泌体 (iRGD-Exo-siS241F-3/siSNRPD2) ,随后通过透射电镜(TEM)、纳米颗粒追踪分析(NTA)验证其形态和纯度。结果发现iRGD-Exo-siS241F-3/siSNRPD2可有效递送siRNA至肿瘤细胞,显著抑制mtp53和SNRPD2表达,同时该工程化外泌体能有效被肿瘤细胞摄取,并敲低靶蛋白。为了评估工程化外泌体的体内抗癌作用,作者构建了裸鼠移植瘤模型,分别采用瘤内注射(ES-2模型)或尾静脉注射(OVCAR-3模型)的方式进行了动物实验。结果发现该工程化外泌体能有效抑制肿瘤生长,与顺铂联用具有协同增效作用,显著增强了化疗敏感性;尾静脉给药也能有效抑制肿瘤,且未观察到明显全身毒性。这些结果表明通过工程化外泌体双重靶向mtp53 和SNRPD2可抑制卵巢肿瘤的生长并增强其对化疗的敏感性。为了进行临床相关性分析,作者对74例高级别浆液性卵巢癌患者的组织样本进行IHC和 IB 检测,结果发现SNRPD2在卵巢癌组织中显著高于正常输卵管组织,且与预后不良相关,进一步突出了其作为卵巢癌治疗靶点的潜力。
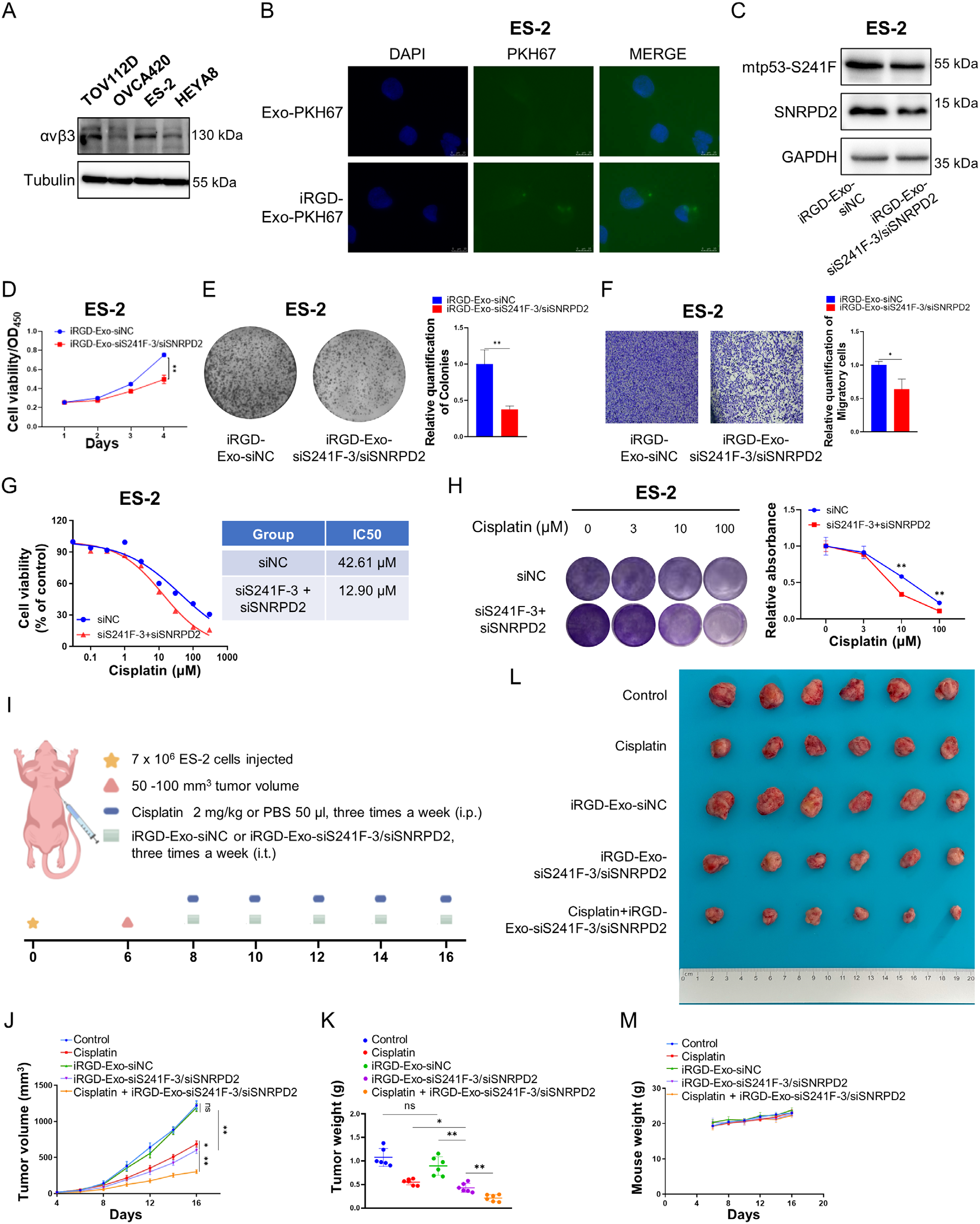
综上所述,作者认为突变型p53(mtp53)与剪接体核心蛋白SNRPD2特异性结合,二者协同促进剪接体组装,并通过调控OTUD3等基因的选择性剪接驱动肿瘤进展。此外,作者开发了由iRGD肽靶向修饰的工程化外泌体(iRGD-Exo-siS241F-3/siSNRPD2),该工程化外泌体在临床前模型中能有效抑制卵巢癌生长,并与顺铂化疗产生协同作用,显著增强了疗效。这项研究揭示了一种由mtp53/SNRPD2调控剪接驱动的致癌新机制,并为其提供了一种具有转化潜力的精准双靶向治疗新策略,尤其对化疗耐药患者具有潜在临床价值。

该研究中,本公司承担了工程化外泌体的透射电镜(TEM)检测和纳米颗粒跟踪分析(NTA),检测数据满足了文章的验证实验需求。本公司拥有HT7700透射电子显微镜以及NanoSight NS300纳米颗粒跟踪分析系统,配备经验丰富的专业人员负责操作,为海量客户提供真实可靠的外泌体鉴定结果。
参考文献:Dual Targeting of Mutant p53 and SNRPD2 via Engineered Exosomes Modulates Alternative Splicing to Suppress Ovarian Cancer.Advanced Science.2026 Jan 20:e13369.
获取全文请扫描下方二维码: