上海宇玫博生物科技有限公司品牌商
8 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
上海宇玫博生物科技有限公司
入驻年限:8 年
- 联系人:
宇玫博
- 所在地区:
上海 浦东新区
- 业务范围:
技术服务、耗材、实验室仪器 / 设备、细胞库 / 细胞培养、论文服务、试剂、原辅料包材
- 经营模式:
生产厂商 经销商 科研机构
推荐产品
公司新闻/正文
IF=33.2 | 揭示肠菌外泌体调控代谢相关性脂肪肝的机制
7126 人阅读发布时间:2025-08-06 10:43

近期,来自广西大学动物科技学院的李一星教授和广西壮族自治区人民医院的周磊教授团队在 Imeta 杂志发表了题为“HLF and PPARα axis regulates metabolic‐associated fatty liver disease through extracellular vesicles derived from the intestinal microbiota”的科研论文,IF=33.2。

研究背景:
代谢相关性脂肪肝(Metabolic‐associated fatty liver disease,MAFLD)是全球最常见的慢性肝病,影响约 25% 的普通人群和超过 50% 的代谢异常患者。肠道是脂质吸收的主要部位,对于脂质代谢的动态平衡非常重要。肝脏和肠道之间存在密切的生理联系,大约 70% 的肝脏血液供应来自肠道循环,通过门静脉将肠道的代谢物、内毒素和炎症介质输送到肝脏。肝脏分泌的胆汁酸和抗体反馈调节肠道屏障功能及菌群平衡,肠道菌群失调和屏障损伤导致内毒素血症,激活肝脏炎症和脂质沉积,促进 MAFLD 进展。肠道菌群释放的细胞外囊泡(fEVs)携带蛋白质、脂质、核酸等生物活性分子,通过门静脉进入肝脏,调控宿主代谢和免疫。肝白血病因子(HLF)是一种转录因子,与心血管疾病、癫痫和肝癌的发生发展有关。研究发现HLF在脂质代谢中发挥重要作用,但其在MAFLD中的具体机制尚不清楚。本研究旨在通过单细胞转录组学、基因敲除小鼠模型和脂质组学分析,深入探讨这些因素在 MAFLD 中的作用,为 MAFLD 的精准医疗提供新的治疗靶点。
研究成果及意义:
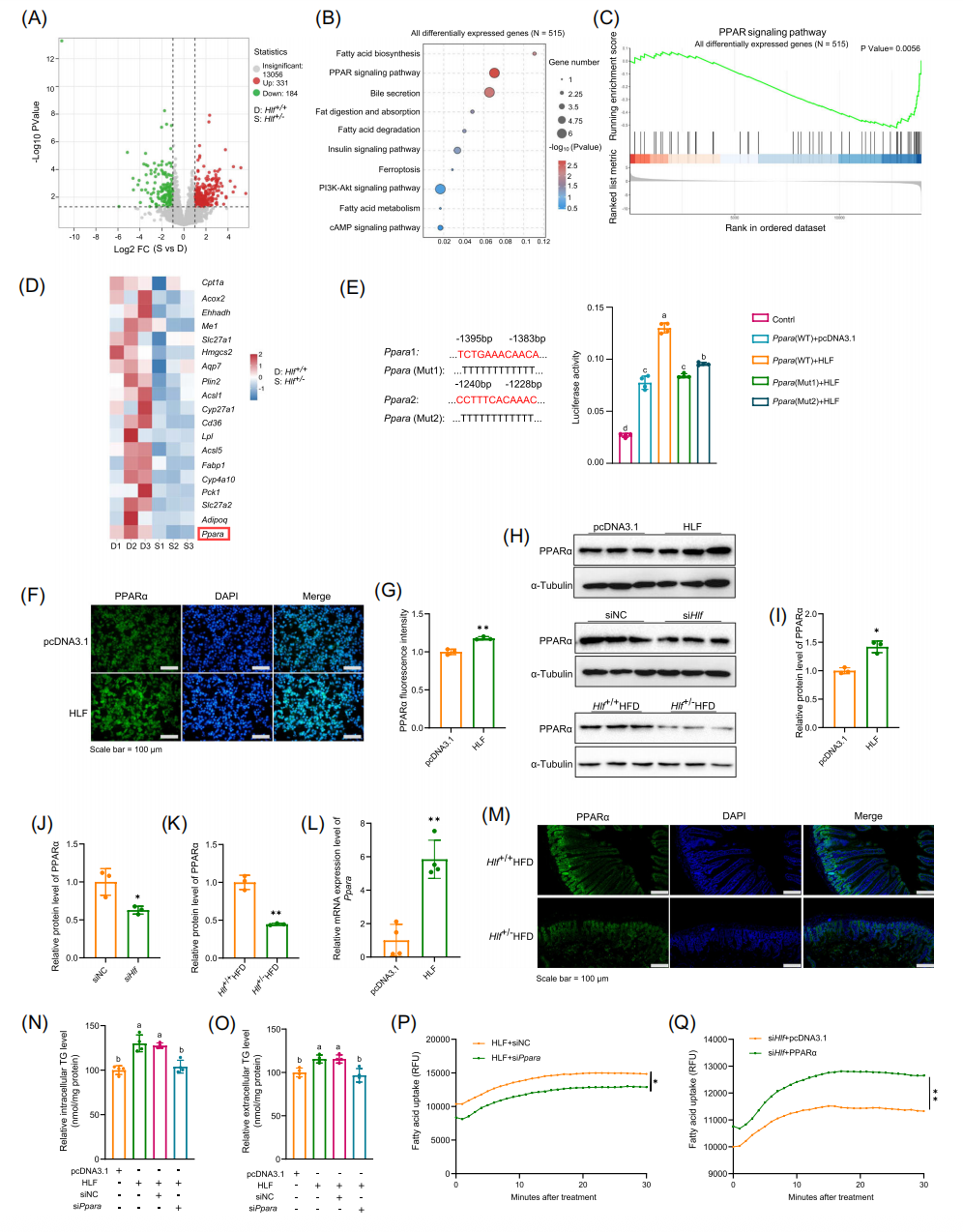
在本研究中,作者首先选取 25-28 岁的自发性 MAFLD 食蟹猴与健康对照组,对两组猴子肠道组织进行单细胞 RNA 测序(scRNA‐seq)和转录组测序(RNA‐seq),结果显示在 MAFLD 组中,吸收细胞、内分泌细胞和杯状细胞的百分比增加,干细胞、转运扩增细胞和簇状细胞的百分比减少;表明肠上皮细胞在脂肪酸、氨基酸和葡萄糖等营养物质的吸收中起着关键作用。随后作者选择对吸收性肠上皮细胞进行功能富集分析,结果发现差异表达基因(DEG)与非酒精性脂肪肝、脂肪酸代谢和过氧化物酶体增殖物激活受体(PPAR)信号传导相关的途径具有显著相关性。在患有 MAFLD 的食蟹猴中,长链脂肪酸吸收细胞的百分比增加,碳水化合物吸收细胞的百分比减少,表明HLF在肠道脂质吸收中具有关键作用。接着作者构建了高脂饮食(HFD)诱导的小鼠 MAFLD 模型和杂合肠道特异性表达的 HLF 敲除小鼠(Hlf+/−)模型,结果发现高脂饮食影响肠道脂质吸收。敲除Hlf通过增加能量代谢来减轻 HFD 引起的代谢变化,Hlf+/− 可降低氧化应激,抑制了铁细胞凋亡,在纯合Hlf敲除小鼠中获得了表明肠特异性Hlf敲除改善 MAFLD 的结果。腹腔注射脂肪酶抑制剂后再灌胃橄榄油,结果显示 Hlf+/− 小鼠的血清游离脂肪酸(FFA)和 TG 明显低于 Hlf+/+ 小鼠,Hlf缺乏还导致肠道紧密连接蛋白 zoonula occludens‐1(ZO‐1)和 occludin 的表达增加。表明Hlf缺乏可能通过增强肠道屏障来抑制外源脂质的消化和吸收。
为了进一步阐明 HLF 的作用机制,作者对饲喂 HFD 的 HLF +/+ 和 HLF +/− 小鼠空肠组织进行了 RNA 测序,DEGs 的K EGG分 析显示 PPAR 信号通路、脂肪酸合成和代谢以及脂肪消化和吸收显著富集,表明 HLF 可促进 PPARα 的表达,而沉默HLF可抑制其表达。而后作者利用 PPARα 抑制剂 GW6471 研究 PPARα 是否参与了小鼠 MAFLD 模型中 HLF 的调控,结果发现与对照组小鼠相比,GW6471 处理小鼠肝脏中 TG 和总胆固醇(TC)水平较低,抑制 PPARα 可减轻脂质沉积和 HFD 引起的肝损以及改善小鼠肠道屏障功能。随后收集粪便进行 16S rDNA 测序,评估肠道微生物群的变化。结果发现HLF通过抑制 PPARα 信号通路,降低氧化应激,改善肠道微生物群的稳态,从而缓解了 MAFLD。然后作者从 GW6471 处理小鼠和肠特异性敲除Hlf的小鼠的肠内容物中分离到 fEV,用来比较 GW6471 处理和对照小鼠对 MAFLD 的影响。结果发现 GW6471 处理的 fEV 和 Hlf+/− fEV 均可通过改善肠屏障功能和抑制铁凋亡来减少肝脏脂肪变性。为了评估 fEV 的体内作用,通过皮下注射给予 8 周龄野生型小鼠对照和GW6471 fEV处理小鼠灌胃并喂食 HFD 12 周。结果发现与对照小鼠相比,给予 GW6471 fEV的小鼠的体重和体脂百分比显著降低,瘦肉百分比显著升高,但它们的摄食量没有差异。表明来自 GW6471 处理小鼠的fEV通过改善肠屏障和抑制铁凋亡来缓解 MAFLD。最后作者通过对照和 GW6471 fEV的脂质组学分析研究fEV对肝脏中脂质代谢的影响。结果显示,与对照组相比,11 种脂质在 GW6471 fEV中上调,100 种脂质在 GW6471 fEV 中下调。前 20 种差异表达的脂质的聚类热图显示肝硬化标志物 SPH 显著下调,并且次级胆汁酸(BA)显著上调。BSH 阳性细菌的减少可能会增加肠道中的结合型胆汁酸(taurochenodeoxycholic acid,TCDCA),当抑制 PPARα 活性或缺乏Hlf时,小鼠肠内容物中 TCDCA 的量增加,这与脂质组学结果一致,是 fEV 中 TCDCA 增加的原因。功能性实验表明,TCDCA 可降低氧化应激并抑制铁凋亡,并参与了 fEV 介导的肝脏脂质代谢调节。
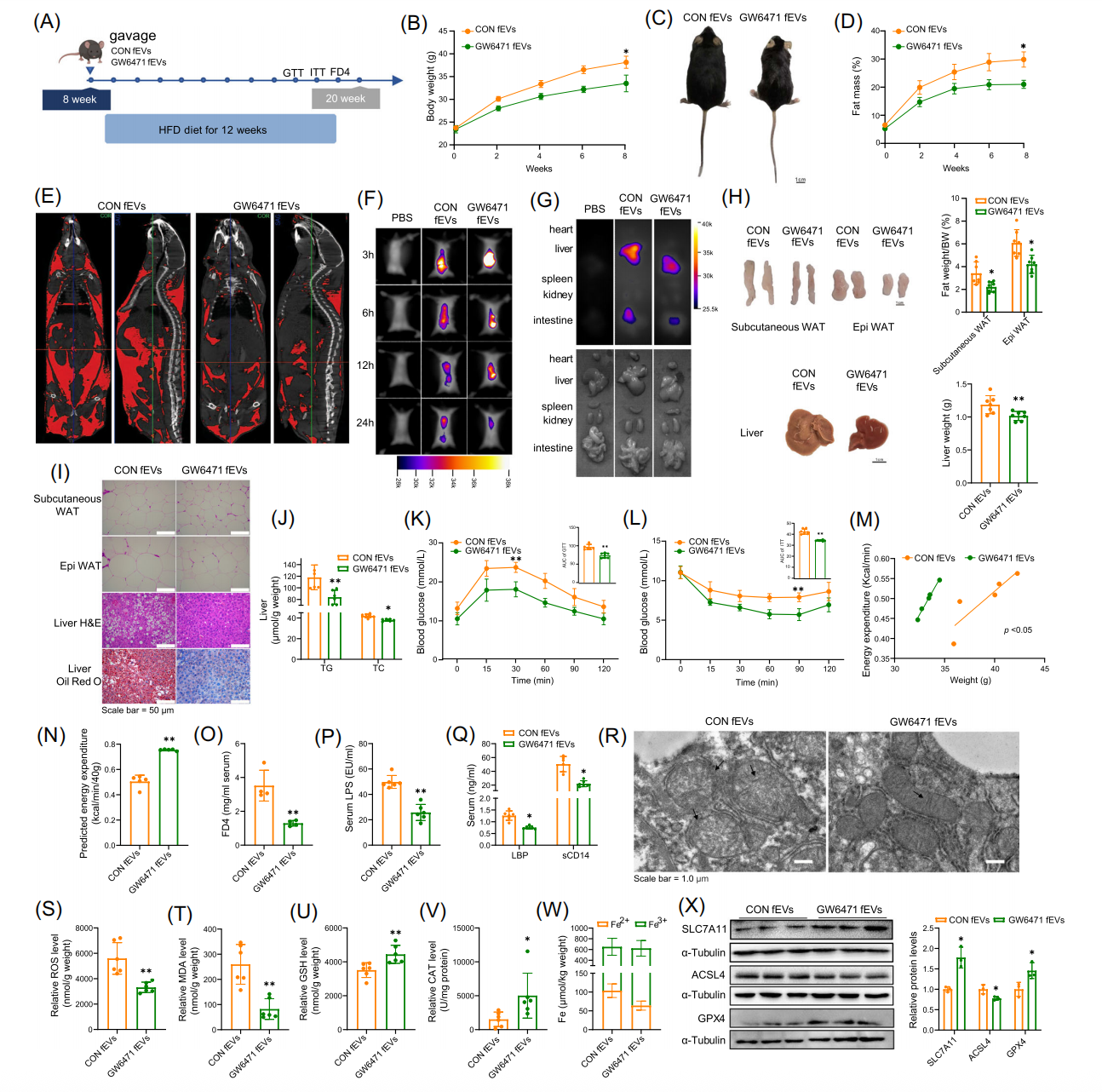
综上所述,作者认为肠道 HLF 结合并激活 PPARα 的转录,增强肠道脂质吸收能力,导致肝脏脂质堆积;HLF/PPARα 轴通过改变肠道菌群组成(减少 BSH 阳性菌),影响fEVs的脂质(增加 TCDCA),从而调控肝脏代谢;fEVs 中的 TCDCA 是调节肝脏脂质代谢的关键因素,能够减少肝脏脂质积累和改善 MAFLD。本文不仅揭示了肠道微生物群与 MAFLD 之间的复杂相互作用,还提出了 fEVs 作为一种潜在的治疗靶点,为开发新的 MAFLD 治疗策略提供了理论基础,这些发现阐明了肠道HLF在调节 MAFLD 中的作用,为靶向肠-肝轴的治疗提供新策略。

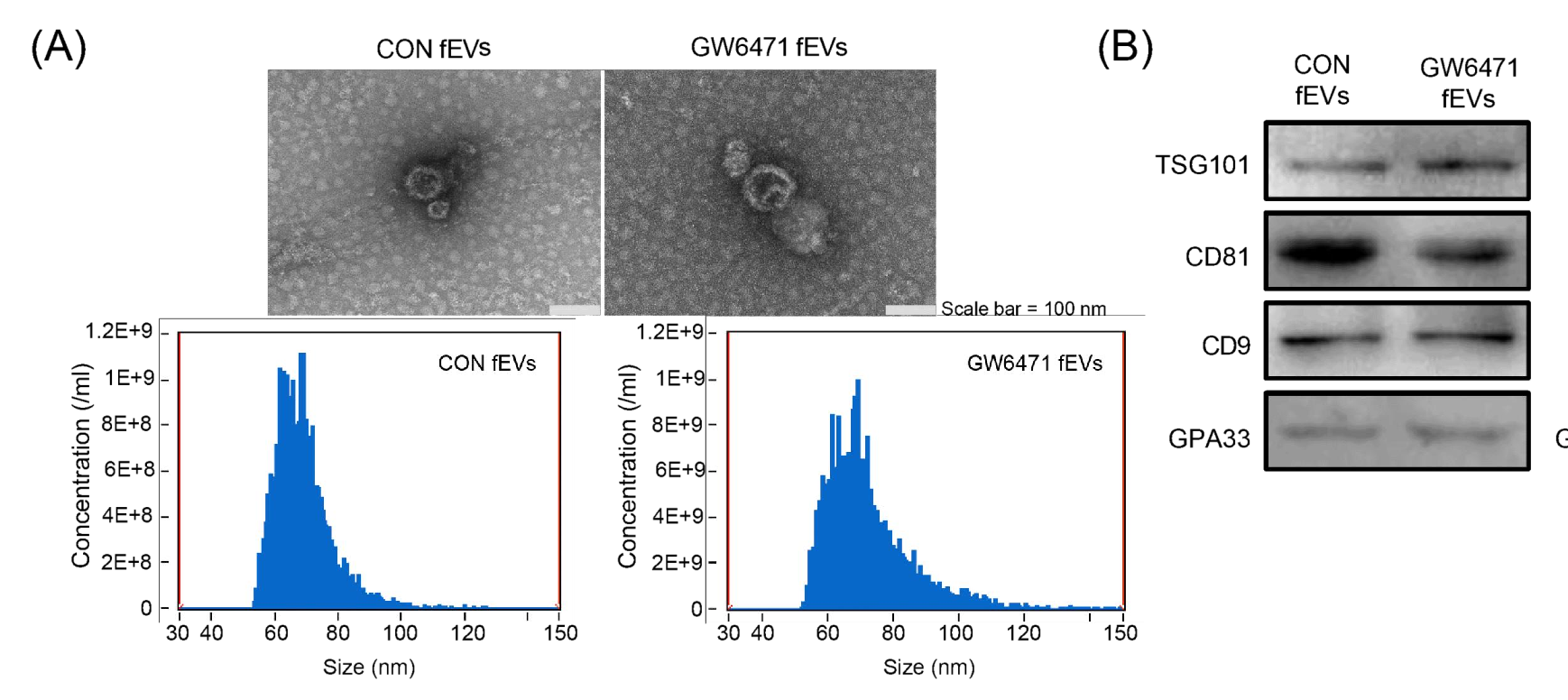
该研究中使用本公司去外泌体胎牛血清(货号:UR50202)培养 HepG2、Caco-2 细胞,然后通过超速离心提取肠道菌群释放的细胞外囊泡(fEVs),使 HepG2、Caco-2 细胞仅暴露于 fEVs,而不会受到血清中其他成分的干扰,从而更准确地评估 fEVs 对细胞功能的影响。结果符合各检测指标要求,满足了客户下游实验需求。
参考文献:HLF and PPARαaxis regulates metabolic‐associated fatty liver disease through extracellular vesicles derived from the intestinal microbiota. Imeta. 2025 Apr 07;4(2):e70022.
获取论文全文请扫描下方二维码: